Operative Therapie des malignen Melanoms
Zuletzt aktualisiert: 23.12.2025 | Autor(in): Prof. Dr. Ingo Stoffels, Dr. Monika Jürgens
Operative Entfernung des Tumors
Bei Verdacht auf ein Melanom sollte die zeitnahe, vollständige Entfernung erfolgen. Nur in wenigen Ausnahmen, wie beispielsweise bei schwierigen Lokalisationen (u.a. im Bereich des Nagelbetts oder nah am Auge) erfolgt zunächst eine Gewebebiopsie zur Sicherung der Diagnose. Nach vollständiger Entfernung erfolgt je nach Tumordicke die Entnahme eines sogenannten Sicherheitsabstandes (siehe Bild 1). Die Tumordicke beschreibt, wie tief das Melanom in die Haut eingewachsen ist. Der erforderliche Sicherheitsabstand beim Melanom liegt zwischen 1 und 2 cm, abhängig von der Tumordicke (siehe Tabelle 1). In Einzelfällen wird von diesen Vorgaben abgewichen, wenn der Tumor sich beispielsweise im Gesicht oder im Genitalbereich befindet und dort aufgrund der Lokalisation nur ein anatomisch angepasster Sicherheitsabstand eingehalten werden kann.
Wundverschluss
Anschließend kann der Wundverschluss erfolgen, je nach Größe z.B. als sogenannte Vorschublappenplastik, Rotationslappenplastik bis hin zur Hauttransplantation. Letztere kann als Vollhauttransplantation oder Spalthauttransplantation erfolgen; hierbei wird Haut in der Größe der zu verschließenden Operationswunde zum Beispiel am Oberschenkel, Oberarm oder am Hals entnommen und in die Wunde transplantiert. Der Vorteil der Spalthaut im Vergleich zur Vollhaut ist, dass Haut mit einer Dicke von 0,3 mm sehr oberflächlich entnommen wird und dementsprechend nur eine oberflächliche Wunde entsteht, die von alleine abheilt. Dies erfolgt meist 2-4 Wochen nach Entfernung des Melanoms, wenn das Gewebe das Hautniveau erreicht hat, damit das Transplantat nicht einsinkt.
Ist die Operationswunde nicht allzu groß, kann sie mittels einer Vorschublappenplastik nach Lockerung des umliegenden Gewebes verschlossen werden. Bei größeren Defekten kann nach Schnittveränderung eine sogenannte Lappenplastik präpariert und diese in die Wunde hinein verlagert werden.
Es gibt darüber hinaus eine Vielzahl an Verschlusstechniken. Das Verfahren wird individuell festgelegt, um ein funktionell und ästhetisch optimales Ergebnis zu erreichen.
| Tumordicke | Seitlicher Sicherheitsabstand |
|---|---|
| ≤ 2 mm | 1 cm |
| > 2mm | 2 cm |
Entnahme des Wächterlymphknotens
Bei einer Tumordicke von > 1 mm oder entsprechenden Risikofaktoren erfolgt zu diagnostischen Zwecken die Entnahme des sogenannten Wächterlymphknotens. Der Wächterlymphknoten ist der erste Lymphknoten, den eine potentielle Melanomzelle erreichen würde. Beispielsweise liegt bei einem Melanom des Oberschenkels der Wächterlymphknoten in der Regel in der Leiste oder bei einem Melanom der Brust in der Achselhöhle (siehe Foto 2). Der Lymphknoten wird vor der Operation mittels einer radioaktiven Substanz (99m Technetium) markiert, die in die Tumorregion gespritzt wird (Szintigraphie). So kann der Lymphabfluss mittels einer speziellen Kamera und einer Sonde dargestellt werden. Es ist möglich, dass auch mehrere Lymphknoten markiert werden. Können bei der anschließenden pathologischen Untersuchung im Wächterlymphknoten Melanomzellen nachgewiesen werden, sagt dies etwas über den Status der Erkrankung aus und hat direkten Einfluss auf die Behandlungsempfehlungen.
Radikale Lymphadenektomie
Werden Lymphknotenmetastasen beispielsweise in einer Bildgebung (Computertomographie oder Ultraschall), oder sogar bereits in der ganzkörperlichen Untersuchung festgestellt, kann die Entfernung aller Lymphknoten im Bereich des Lymphabflussgebietes sinnvoll sein.
Satelliten- oder In-Transit-Metastasen
Bei Metastasen in der Haut oder im Unterhautfettgewebe kann, unter Berücksichtigung des Behandlungskonzeptes, eine operative Entfernung ebenso erfolgen. Eine weitere Therapiemöglichkeit ist die Elektrochemotherapie. Hierbei handelt es sich um eine Kombination der Verwendung elektrischer Impulse in Verbindung mit der Verwendung begrenzt membranpenetrierender Chemotherapien (Bleomycin). Durch die elektrischen Impulse wird die Membrandurchlässigkeit der Tumorzelle erhöht. Hierdurch können Medikamente besser eindringen und wirken. Dieser Effekt ist begrenzt auf den Bereich, in dem die elektrischen Impulse verabreicht werden.
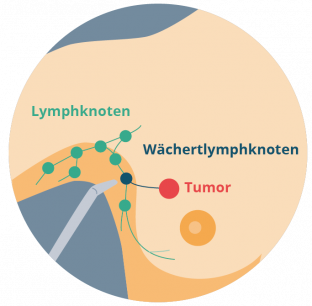
Bild 2: Wächterlymphknoten (Quelle: https://www.apotheken-umschau.de/diagnose/diagnoseverfahren/biopsie-entnahme-einer-gewebeprobe-742789.html)
Bei Verdacht auf ein Melanom sollte die zeitnahe und vollständige operative Entfernung erfolgen.
Je nach Tumordicke sollte die Entfernung eines Sicherheitsabstandes und zu diagnostischen Zwecken die Entnahme eines Wächterlymphknotens erfolgen.
- REFERENZEN
- [1] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Melanoms.
- [2] Lodde G, Zimmer L, Livingstone E, Schadendorf D, Ugurel S. Malignes Melanom [Malignant melanoma]. Hautarzt. 2020 Jan;71(1):63-77. German. doi: 10.1007/s00105-019-04514-0. PMID: 31773173.
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Medikamentöse Therapie: Einführung
Zuletzt aktualisiert: 22.04.2025 | Autor(in): Friedegund Meier
Einführung
Vor und nach der operativen Entfernung eines Tumors und/oder seiner Metastasen bestehen zusätzliche Behandlungsmöglichkeiten, die den Krankheitsverlauf positiv beeinflussen und dadurch verbessern können.
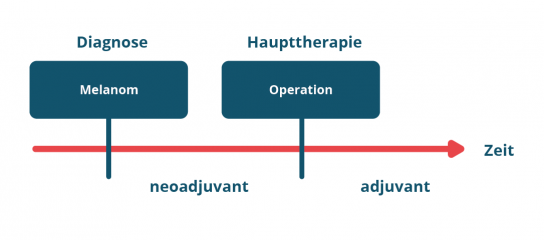
Man unterscheidet dabei sogenannte neo-adjuvante Therapien und adjuvante Therapien
(Abbildung 1).
Neo-adjuvante Therapien werden vor der Operation eines Tumors angewandt. Beim Melanom werden für eine neo-adjuvante Behandlung bestimmte Medikamente angewendet.
Adjuvante Therapien werden nach der Operation eines Tumors angewandt und können sowohl aus einer Behandlung mit bestimmten Medikamenten oder einer Behandlung durch Bestrahlung bestehen oder auch einer Kombination aus beidem.
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Medikamentöse Therapie vor der Operation: Die neo-adjuvante Therapie
Zuletzt aktualisiert: 05.05.2025 | Autor(in): Friedegund Meier
Bitte beachten Sie, dass die neoadjuvante Therapie zurzeit noch nicht zugelassen ist.
Einführung und Stand der Forschung
Die neoadjuvante Therapie ist eine medikamentöse Therapie von vorhandenen Metastasen, die vor der operativen Entfernung stattfindet. Mögliche Vorteile einer neoadjuvanten Therapie von Metastasen sind u.a.
- die Verkleinerung des Tumors vor der operativen Therapie und
- die Auslösung einer stärkeren Immunreaktion im Vergleich zu einer medikamentösen adjuvanten Therapie nach operativer Entfernung des Tumors.
Außerdem kann der feingewebliche (histologische) Befund des operativ entfernten Tumors bei der Entscheidung helfen, ob nach der Operation eine adjuvante Behandlung angeschlossen werden sollte. Der feingewebliche Befund kann auch bei der Einschätzung des Krankheitsverlaufes und Planung der weiteren Nachsorge helfen. Aktuell wird die Wirksamkeit und Sicherheit neoadjuvanter Therapien für Patienten mit metastasiertem Melanom in klinischen Studien untersucht. Inzwischen liegen Studiendaten vor (s. Stand der Forschung).
- Stand der Forschung
In der 2023 veröffentlichten SWOG S1801-Studie (Referenz: doi 10.1056/NEJMoa2211437) wurden für Patienten mit operablen Melanommetastasen (Stadium IIIB-IVC) zwei Behandlungen verglichen. Im neoadjuvanten-adjuvanten Behandlungsarm erhielten die Patienten drei Infusionen mit dem PD-1 Hemmer Pembrolizumab. Dann wurden die Metastasen operativ entfernt. Nach der Operation erhielten die Patienten fünfzehn Infusionen Pembrolizumab. Im nur adjuvanten Behandlungsarm wurden die Metastasen operativ entfernt. Nach der Operation erhielten die Patienten achtzehn Infusionen Pembrolizumab. Bei den Patienten, die Pembrolizumab sowohl vor als auch nach der Operation erhielten, war das ereignisfreie Überleben deutlich länger als bei den Patienten, die nur Pembrolizumab nach der Operation erhielten. Es wurden keine bisher unbekannte Nebenwirkungen beobachtet.
In der 2024 veröffentlichten NADINA-Studie (Referenz: doi 10.1056/NEJMoa2402604) wurden Patienten mit operablen Lymphknotenmetastasen und maximal drei In-Transit-Metastasen ohne Fernmetastasen (Stadium III) in zwei Behandlungsgruppen eingeteilt. In der neoadjuvanten-adjuvanten Behandlungsgruppe erhielten die Patienten zwei Infusionen mit Ipilimumab plus Nivolumab. Dann wurden die Metastasen operativ entfernt. Patienten mit teilweisem Ansprechen oder Nichtansprechen erhielten eine adjuvante Behandlung. Patienten mit komplettem bzw. nahezu komplettem Ansprechen erhielten keine adjuvante Behandlung. Im nur adjuvanten Behandlungsarm wurden die Metastasen operativ entfernt. Nach der Operation erhielten die Patienten adjuvant 12 Infusionen mit Nivolumab. Die neoadjuvante Behandlung mit Ipilimumab plus Nivolumab, gefolgt von der operativen Entfernung der Metastasen und einer adjuvanten Therapie in Abhängigkeit vom Therapieansprechen erzielte ein längeres ereignisfreies Überleben als eine Operation gefolgt von einer adjuvanten Nivolumab-Therapie.
Ein wesentliches Ziel der neoadjuvanten Therapie ist die Verkleinerung des Tumors bzw. der Metastasen vor der operativen Therapie.
Bisher ist die neoadjuvante Therapie mit Nivolumab plus Ipilimumab für Patienten mit metastasiertem Melanom nicht zugelassen.
- REFERENZEN
- [1] C. U. Blank, ‘First safety and efficacy results of PRADO: A phase II study of personalized response-driven surgery and adjuvant therapy after neoadjuvant ipilimumab (IPI) and nivolumab (NIVO) in resectable stage III melanoma., J Clin Oncol 38: 2020 (suppl; abstr 10002).
- [2] E. A. Rozeman et al., ‘Identification of the optimal combination dosing schedule of neoadjuvant ipilimumab plus nivolumab in macroscopic stage III melanoma (OpACIN-neo): a multicentre, phase 2, randomised, controlled trial’, Lancet Oncol., vol. 20, no. 7, pp. 948–960, Jul. 2019.
- Patel, S.P.; Othus, M.; Chen, Y.; Wright, G.P., Jr.; Yost, K.J.; Hyngstrom, J.R.; Hu-Lieskovan, S.; Lao, C.D.; Fecher, L.A.; Truong, T.G.; et al. Neoadjuvant-Adjuvant or Adjuvant-Only Pembrolizumab in Advanced Melanoma. N. Engl. J. Med. 2023, 388, 813–823
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Medikamentöse Therapie nach der Operation: Die adjuvante Therapie
Zuletzt aktualisiert: 22.04.2024 | Autor(in): Prof. Dr. med. Friedegund Meier
Einführung und Stadien
Adjuvante Therapie – warum?
Auch wenn nach der operativen Entfernung eines Tumors in den radiologischen Untersuchungen nichts Auffälliges mehr zu sehen ist, können dennoch kleinste Tumorreste oder vereinzelte Tumorzellen im Körper vorhanden sein. Um diese zu bekämpfen, wird eine adjuvante (unterstützende) Behandlung im Anschluss empfohlen. Sie kann verhindern, dass der Tumor wieder wächst bzw. Metastasen (Absiedlungen) bildet, also dass es zu einem Rezidiv (Rückfall) kommt. Es gibt verschiedene Möglichkeiten der adjuvanten Behandlung. Im folgenden Abschnitt wird beschrieben, wann welche adjuvante Therapie empfohlen wird.
Adjuvante Therapie – wann?
- Stadium I
Im Stadium I ist keine adjuvante Therapie erforderlich. Alle Patienten sollten allerdings regelmäßig zu den Nachsorgeuntersuchungen gehen. [1]
- Stadium II
Im Stadium II ist der Tumor zwar noch immer auf seinen Ursprungsort begrenzt, aber schon etwas dicker oder/und weist unter dem Mikroskop eine Ulzeration (Verletzung) auf. Dadurch ist das Rückfallrisiko höher als im Stadium I. Daher wird von der medizinischen Leitlinie zur Behandlung des malignen Melanoms empfohlen, gemeinsam mit dem Patienten adjuvante Behandlungsmöglichkeiten innerhalb oder außerhalb einer klinischen Studie zu besprechen. Außerhalb einer Studie wurde in der Vergangenheit eine Immuntherapie mit Interferon angeboten. Interferon steht aktuell jedoch nicht mehr zur Verfügung. [1] Vielmehr wird nun eine Immuntherapie mit den PD-1-Hemmern Pembrolizumab oder Nivolumab zur adjuvanten Behandlung des Melanoms in den Stadien IIB oder IIC nach vollständiger Resektion angeboten.
- Stadium III und IV
Das wichtigste Ziel einer adjuvanten Therapie in diesen Stadien ist die Senkung des Rezidivrisikos, um das Wiederauftreten des Tumors zu verhindern.
Im Stadium III hat sich der Tumor innerhalb der Haut in die unmittelbare Umgebung ausgebreitet oder Absiedlungen in den Lymphknoten gebildet. Nach vollständiger Entfernung des Tumors ist das Rückfallrisiko ohne eine weitere Therapie erhöht. Weiterhin ist die Prognose (Vorhersage des weiteren Krankheitsverlaufs) davon abhängig, in welchem Unterstadium sich die Erkrankung befindet.
Im Stadium IV hat das Melanom Metastasen an weiter entfernt liegenden Stellen des Körpers bzw. in Organen gebildet. Diese werden Fernmetastasen genannt. Wenn diese durch eine Operation vollständig entfernt werden konnten, bietet eine adjuvante Immuntherapie auch Patienten im Stadium IV die Möglichkeit, das Rückfallrisiko zu verringern. [1]
Als Rückfall (Rezidiv) wird das Wiederauftreten eines Tumors bezeichnet, der zunächst erfolgreich behandelt wurde. Um das Risiko für einen Rückfall zu senken, wird bestimmten Patienten nach der Operation eine zusätzliche Therapie mit Medikamenten oder durch Bestrahlung angeboten.
Adjuvante Therapien können Rückfälle bzw. Metastasen eines Tumors verhindern.
- REFERENZEN
- [1] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Melanoms. Die S3-Leitlinie wurde überarbeitet und um das neue Kapitel „Adjuvante Therapie“ ergänzt.
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Wirkmechanismen
Zuletzt aktualisiert: 22.04.2025 | Autor(in): Prof. Dr. med. Friedegund Meier
Wie wirkt die Immuntherapie mit PD-1 Hemmern?
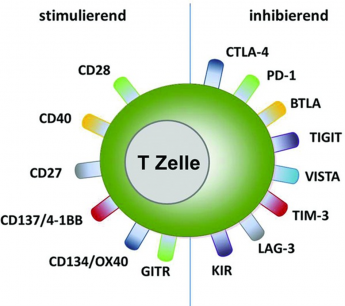
Normalerweise ist das menschliche Immunsystem mit Abwehr- und Immunzellen (T-Zellen) in der Lage, Krebszellen als unerwünschte Eindringlinge zu erkennen und zu vernichten. Damit diese Reaktionen nicht überschießen und sich gegen gesundes Gewebe richten, gibt es im Immunsystem bestimmte Kontrollstellen (Checkpoints). Diese sorgen dafür, dass das Immunsystem im Gleichgewicht bleibt. [1]
Damit das funktioniert, tauschen bestimmte Eiweiße über die Kontrollstellen Signale aus. Ein solcher Eiweißstoff ist PD-1. Dieser befindet sich, neben zahlreichen anderen Eiweißen, auf der Oberfläche der T-Zellen (Abbildung 1). Krebszellen können diese Kontrollstellen nutzen, um zu verhindern, dass sie vom Immunsystem erkannt werden. Dazu bilden sie auf ihrer Oberfläche vermehrt das Bindungsmolekül PD-L1 aus, welches mit PD-1 der T-Zellen in Wechselwirkung tritt. Dadurch wird die T-Zelle inaktiviert und kann die Krebszellen nicht mehr zerstören – das Immunsystem wird gebremst. [2]
Checkpoint-Inhibitoren: Das Immunsystem wieder aktivieren
Bestimmte Wirkstoffe können diese Bremse wieder lösen. Diese Medikamente heißen Immuncheckpoint-Hemmer. PD-1-Hemmer sind Immuncheckpoint-Hemmer. PD-1-Hemmer blockieren die Wechselwirkung zwischen PD-1 auf der T-Zelle und PD-L1 auf der Krebszelle, welche zur Unterdrückung des Immunsystems führt. Hierdurch wird die T-Zelle wieder aktiviert und kann die Krebszellen zerstören (Abbildung 1). [2]
Wie wirkt die zielgerichtete Therapien mit BRAF-/MEK Hemmern?
Was ist eine BRAF-Mutation?
Bei etwa der Hälfte der Melanome (ca. 50 %) spielt eine Mutation des BRAF-Gens (oder des BRAF-Proteins) eine wichtige Rolle für das Tumorwachstum [2] Das BRAF-Protein und das nachgeschaltete MEK-Protein sind Mitglieder einer Signalübertragungskette in der Zelle. Eine BRAFV600-Mutation in den Krebszellen führt zu einer ständigen Aktivierung dieser Signalübertragungskette und somit zu einem unkontrollierten Wachstum der Krebszellen. Diese Erkenntnis hat dazu geführt, dass Medikamente entwickelt werden konnten, die gezielt die BRAF- und MEK-Proteine in der Signalübertragungskette ausschalten (Abbildung 2). Diese Art der Behandlung , die den Tumor gezielt angreift, wird auch als zielgerichtete Therapie bezeichnet.
Den Tumor direkt angreifen: Kombinationstherapie bei BRAF-Mutation
Mit einer zielgerichteten Melanomtherapie mit BRAF-/MEK-Hemmern kann neben dem veränderten BRAF-Protein zusätzlich das MEK-Protein ausgeschaltet werden. Somit lassen sich zwei wichtige Schaltstellen des Signalweges beeinflussen. Eine zielgerichtete Kombinationstherapie, die das BRAF-Protein und das MEK-Protein blockiert, kann also die ständig aktivierte Signalübertragung in den Krebszellen und somit das unkontrollierte Krebszellwachstum an zwei Stellen stoppen.[3]
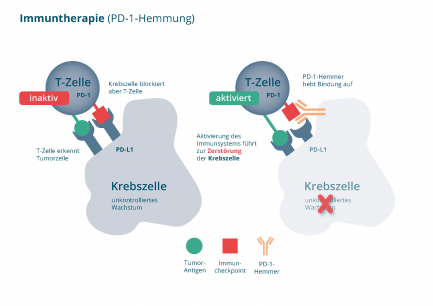
Abbildung 1: Medikamente zur Immuntherapie (Immun-Checkpoint-Hemmer wie z.B. PD1-Hemmer): Wiederaktivierung von T-Zellen (Abwehrzellen), die die Krebszellen zerstören (Quelle: NVKH Entscheidungshilfe)
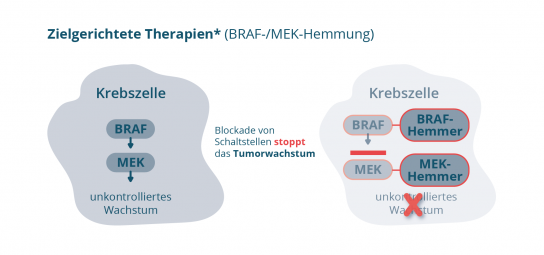
*Bei Vorliegen einer BRAFV600-Mutation. Abbildung 2: Medikamente zur zielgerichteten Therapie (z.B. BRAF- und MEK-Hemmer): Stoppen das unkontrollierte Wachstum der Krebszellen (Quelle: NVKH Entscheidungshilfe)
Wirkmechanismen adjuvanter Therapien in aller Kürze: Man unterscheidet grundsätzlich zwei verschiedene Arten von Medikamenten, die zur unterstützenden Behandlung nach vollständiger operativer Entfernung des Tumors bzw. der Metastasen eingesetzt werden können: die Immuntherapie mit PD-1-Hemmern und die zielgerichtete Therapie mit BRAF-/MEK-Hemmern.
PD-1 Hemmer aktivieren das Abwehrsystem wieder.
Die zielgerichtete Therapie mit BRAF-/MEK-Hemmern stoppt das unkontrollierte Wachstum der Krebszellen.
- REFERENZEN
- [1] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Melanoms. Die S3-Leitlinie wurde überarbeitet und um das neue Kapitel „Adjuvante Therapie“ ergänzt.
- [2] Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12:252–264
- [3] Griffin M et al. BRAF inhibitors: resistance and the promise of combination treatments for melanoma. Oncotarget. 2017;8(44):78174–78192
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Nebenwirkungen
Zuletzt aktualisiert: 22.04.2025 | Autor(in): Prod. Dr. med. Friedegund Meier
In der Regel werden die Medikamente zur adjuvanten Therapie des Melanoms ein Jahr lang gegeben. Im besten Fall werden sie gut vertragen und wirken sich nicht negativ auf das Befinden der Patienten aus. Aber auch wenn Nebenwirkungen auftreten sollten, lassen diese sich in der Regel gut behandeln.
ESMO Patientenleitlinie zu "Immuntherapie-bedingte Nebenwirkungen und ihr Management".
- Immuntherapie mit PD-1 Hemmern
Vor Beginn der Therapie werden Sie ausführlich über mögliche Nebenwirkungen und Verhaltensmaßnahmen aufgeklärt. Der Arzt/ die Ärztin wird Ihnen vielleicht auch eine Patienteninformation und einen Patientenpass mitgeben, die unter anderem Informationen zur Therapie, zu Nebenwirkungen, Ansprechpartnern und Kontaktdaten für den Notfall enthalten. Vor Beginn der Behandlung und vor jeder Infusion werden Blutwerte kontrolliert. Wenn Nebenwirkungen auftreten, sollten sie so früh wie möglich behandelt werden. Gegebenenfalls muss die Therapie mit dem PD-1-Hemmer für eine gewisse Zeit unterbrochen und vorübergehend Medikamente für die Nebenwirkung gegeben werden. Diese bremsen die überschießende Reaktion des Immunsystems. Meistens wird hierfür vorübergehend Kortison eingesetzt. [1]
- Zielgerichtete Therapie mit BRAF-/MEK-Hemmern
Vor Beginn der Therapie werden Sie ausführlich über mögliche Nebenwirkungen und Verhaltensmaßnahmen aufgeklärt. Der Arzt/die Ärztin wird Ihnen vielleicht auch eine Patienteninformation und einen Patientenpass mitgeben, die unter anderem Informationen zur Therapie, zu Nebenwirkungen, Ansprechpartnern und Kontaktdaten für den Notfall enthalten. Vor Beginn und während der Behandlung werden Kontrolluntersuchungen durchgeführt, zum Beispiel Blutentnahmen für die Kontrolle von Laborwerten. Wenn Nebenwirkungen auftreten, sollten diese zeitnah behandelt werden. Hierfür gibt es verschiedene Maßnahmen. So können Ärzte bei Fieberschüben oder Gelenkschmerzen Arzneimittel verordnen, die auch bei Beschwerden im Rahmen eines grippalen Infekts zum Einsatz kommen. Gegen einen erhöhten Blutdruck gibt es ebenfalls Medikamente. Bei Erschöpfung können körperliche Aktivität bzw. Sport helfen. In manchen Fällen entscheidet Ihr Arzt/Ihre Ärztin, die Dosis eines der Medikamente zu verringern oder die Therapie vorübergehend zu pausieren. [2,3]
Adjuvante Therapie mit PD-1-Hemmern: Was können Sie selbst tun? Da Sie als Patient/in Beschwerden bzw. Veränderungen zuerst bemerken, können Sie verantwortungsvoll handeln. Melden Sie sich in diesem Fall sobald wie möglich bei Ihrem Arzt/ Ihrer Ärztin oder dem medizinischen Personal. Die aktuellen Kontaktdaten finden Sie in Ihrem Patientenpass oder anderen Ihnen ausgehändigten Unterlagen. Solche Beschwerden können beispielsweise Durchfall, Hautausschlag, Husten, Atembeschwerden, Müdigkeit oder Kopfschmerzen sein.
Adjuvante Therapie mit BRAF-/MEK-Hemmern: Was können Sie selbst tun? Achten Sie darauf, die Tabletten bzw. Kapseln jeden Tag zum gleichen Zeitpunkt einzunehmen, und zwar mindestens eine Stunde vor oder frühestens zwei Stunden nach einer Mahlzeit. Da Sie als Patient Veränderungen bzw. Beschwerden zuerst bemerken, können Sie verantwortungsvoll handeln. Melden Sie sich in diesem Fall sobald wie möglich bei Ihrem Arzt / Ihrer Ärztin oder dem medizinischen Personal. Die aktuellen Kontaktdaten finden Sie in Ihrem Patientenpass oder anderen Ihnen ausgehändigten Unterlagen. Solche Beschwerden können beispielsweise Fieber (ab 38,5 °C), Hautausschlag oder Müdigkeit sein.
- REFERENZEN
- [1] J. R. Brahmer et al., ‘Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: American Society of Clinical Oncology Clinical Practice Guideline’, J. Clin. Oncol., vol. 36, no. 17, pp. 1714–1768, 10 2018.
- [2] Fachinformation Dabrafenib 11/2019
- [3] Fachinformation Trametinib 11/2019
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Medikamentöse Therapie des metastasierten Melanoms, Stadium IV
Zuletzt aktualisiert: 22.04.2025 | Autor(in): Prof. Dr. med. Friedegund Meier, Dr. med. Svea Hüning
Einführung
Absiedlungen von Melanomzellen (= Metastasen) in ferne Körperregionen und Organe wie Leber, Lunge oder Gehirn nennt man Fernmetastasen. Das bei Fernmetastasen vorliegende Krankheitsstadium wird als Stadium IV bezeichnet. Beim Auftreten solcher Fernmetastasen ist der Krankheitsverlauf deutlich ungünstiger als bei melanomerkrankten Personen ohne Metastasen.
Bis vor einem Jahrzehnt verstarben Menschen mit Fernmetastasen in der Regel innerhalb eines Jahres. Durch neue und bessere Behandlungsmöglichkeiten erreicht inzwischen mehr als die Hälfte der Patientinnen und Patienten ein Langzeitüberleben.
In den folgenden Kapiteln sollen die bei Fernmetastasen häufig verwendeten Systemtherapien (auf den ganzen Körper wirkend) besprochen werden. Es wird grundsätzlich zwischen drei Behandlungsmöglichkeiten unterschieden:
- Immuntherapie mit Checkpoint-Hemmern: (syn. Immun-Checkpoint-Inhibitoren) Checkpoint-Hemmer lösen die Bremsen des Immunsystems, d.h. sie aktivieren Abwehrzellen (= T-Zellen) des körpereigenen Immunsystems, die die Krebszellen zerstören.
- Signalweg-Hemmer (zielgerichtete Therapie): Signalweg-Hemmer blockieren Signalübertragungswege, die das Überleben und das Wachstum von Krebszellen fördern. Ziel der Krebstherapie ist es, durch die Hemmung dieser Signalwege das Überleben und das unkontrollierte Wachstum von Krebszellen zu hemmen.
- Chemotherapie: Chemotherapien sollen die Zellteilung verhindern. Da sich Krebszellen in der Regel schnell teilen, wirken Chemotherapien insbesondere auf diese Zellen. Es handelt sich jedoch um eine ungerichtete Therapie. Das bedeutet, dass sie nicht ausschließlich auf Krebszellen gerichtet ist, sondern auch andere sich schnell teilende gesunde Zellen angegriffen werden.
Welche Therapie in Ihrem individuellen Fall am besten geeignet ist, hängt von verschiedenen Faktoren ab, unter anderem von dem Mutationsstatus und den Vorerkrankungen. Der Mutationsstatus wird anhand von entnommenem Gewebe bestimmt, entweder von dem ursprünglichem Melanom (= Primärtumor) oder einer Metastase. Mutationen sind Veränderungen der Gene. Bei fast 50% der Melanome findet man ein verändertes BRAF-Gen, also eine BRAF-Mutation. Bei bis zu 25% der Melanome findet man eine NRAS-Mutation. Bei Melanomen in besonderen Körperregionen wie den Schleimhäuten oder den Augen gibt es noch weitere relevante Mutationen (siehe Kapitel Uvea-Melanom und Schleimhautmelanom).
Wenn in den folgenden Texten von einer "mittleren" Überlebenszeit oder einer "durchschnittlichen" Verbesserung des Überlebens gesprochen wird, muss vorab gesagt werden, dass es sich dabei um statistische Werte handelt. Diese Zahlen geben einen allgemeinen Hinweis darauf, wie wirksam ein Medikament bei einer größeren Gruppe von Betroffenen ist. Es lässt keine direkten Rückschlüsse auf Ihr persönliches Therapieansprechen zu.
Bei der Ausbildung von Fernmetastasen spricht man von einem Krankheitsstadium IV.
Behandlungsoptionen stellen insbesondere die Immuntherapie mit Checkpoint-Hemmern und die zielgerichtete Therapie mit Signalweg-Hemmern dar.
Bei fast 50% der Betroffenen liegt eine BRAF-Mutation vor.
- REFERENZEN
- [1] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Patientenleitlinie – Melanom, Eine Leitlinie zur Untersuchung, Behandlung und Nachsorge des schwarzen Hautkrebses, Stand: Mai 2019Letzter Zugriff: 03.09.2020
- [2] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Melanoms, Langversion 3.3, 2020, AWMF Registernummer: 032/024OLLetzter Zugriff: 03.09.2020
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Immuntherapie
Zuletzt aktualisiert: 05.05.2025 | Autor(in): Prof. Dr. med. Friedegund Meier, Dr. med. Svea Hüning
Bei der Immuntherapie mit Checkpoint-Hemmern sollen Abwehrzellen (= T-Zellen) des körpereigenen Immunsystems (wieder) aktiviert werden, die die Krebszellen zerstören. Häufige Nebenwirkungen sind daher auf überschießende Reaktionen des Immunsystems zurückzuführen, ähnlich wie bei einer klassischen Autoimmunkrankheit. Insbesondere sind von dieser überschießenden Aktivierung des Immunsystems der Magen-Darm-Trakt, das Hormonsystem, die Haut und die Leber betroffen. Die Medikamente werden über die Vene in unterschiedlichen zeitlichen Abständen verabreicht, abhängig vom Wirkstoff und der Verträglichkeit.
In Deutschland stehen als Checkpoint-Hemmer die beiden PD-1-Antikörper Nivolumab und Pembrolizumab, sowie der CTLA4-Antikörper Ipilimumab zur Verfügung. Es ist möglich, die Wirkstoffe einzeln anzuwenden oder den CTLA4-Antikörper Ipilimumab mit dem PD-1-Antikörper Nivolumab zu kombinieren.
- CTLA4-Antikörper
Ipilimumab war der erste für das Melanom zugelassene Checkpoint-Hemmer. Nach fünf Jahren leben ungefähr 20 von 100 Erkrankten nach der Behandlung mit Ipilimumab. Es konnte gezeigt werden, dass Patientinnen und Patienten, die länger als 3 Jahre nach der Behandlung leben, nur noch sehr selten an den Folgen des Melanoms sterben, sodass von Langzeitüberlebenden gesprochen wird. Die Anwendung von Ipilimumab in der Therapie des Melanoms war ein bedeutender Meilenstein. Dennoch wird heutzutage eine Therapie mit Ipilimumab allein kaum noch angewendet.
- PD-1-Antikörper
Die beiden PD-1-Antikörper Nivolumab und Pembrolizumab zeigen vergleichbar gute Therapieergebnisse bei ähnlichen Nebenwirkungen. Da die alleinige Therapie (= Monotherapie) mit einem PD-1-Antikörper der alleinigen Therapie mit Ipilimumab in der Wirksamkeit überlegen ist und es zu weniger schweren Nebenwirkungen kommt, werden sie als Einzeltherapie gegenüber Ipilimumab vorgezogen.
- CTLA4- + PD1-Antikörper
Eine weitere Behandlungsmöglichkeit stellt die Kombination eines PD-1-Antikörpers (Nivolumab) mit dem CTLA4-Antikörper Ipilimumab dar. Unter dieser Therapie Unter dieser Therapie leben nach 10 Jahren 52 von 100 Patientinnen und Patienten [2]. Diese Therapie scheint damit sowohl der Monotherapie mit einem CTLA4-Antikörper als auch der Monotherapie mit einem PD-1-Antikörper überlegen zu sein. Zu beachten ist jedoch, dass es zu einem deutlichen Anstieg der schweren Nebenwirkungen kommt.
Nebenwirkungen unter einer Therapie mit Checkpoint-Hemmern
Die Nebenwirkungen unter einer Therapie mit Checkpoint-Hemmern werden durch Autoimmunreaktionen verursacht, da sich das Immunsystem nicht nur gegen die Tumorzellen, sondern auch gegen gesunde Zellen richten kann. Die häufigsten Nebenwirkungen sind Hautausschläge und Entzündungen der Darmschleimhaut mit Durchfällen, wobei prinzipiell jedes Organ betroffen sein kann.
Unter der Therapie mit PD-1-Antikörpern alleine treten bei 20 von 100 Prozent der Patientinnen und Patienten schwere Nebenwirkungen auf und unter Nivolumab plus Ipilimumab bei ca. 60 Prozent. Da diese Nebenwirkungen auch nicht umkehrbar sein können (unter Nivolumab plus Ipilimumab bei bis zu 20 von 100 Patientinnen und Patienten Schilddrüsenentzündung mit bleibender Schilddrüsenunterfunktion) oder sogar sehr selten (0,4 - 1,2%) tödlich verlaufen können, ist es von großer Bedeutung, hier alle Beteiligten gut zu informieren: die Erkrankten, die Angehörigen, die mitbehandelnden Ärztinnen und Ärzte. Ebenso ist es wichtig, die Nebenwirkungen frühzeitig zu erkennen und leitliniengerecht zu behandeln. Dann bestehen gute Aussichten, dass sich der Großteil der Nebenwirkungen komplett zurückbildet. [MF1]Link zur ESMO Guideline für Patienten zum Thema Nebenwirkungen
Als Immuntherapie mit Checkpoint-Hemmern stehen die beiden PD-1-Antikörper Nivolumab und Pembrolizumab sowie der CTLA4-Antikörper Ipilimumab zur Verfügung.
Es wird empfohlen, die PD-1-Antikörper einzeln anzuwenden oder den CTLA4-Antikörper Ipilimumab mit dem PD-1-Antikörper Nivolumab zu kombinieren.
Die Therapie wird als Infusion über die Vene verabreicht.
Checkpoint-Hemmer können bei mehr als 50% der Patientinnen und Patienten ein Langzeitüberleben erreichen.
Unter der Therapie mit Checkpoint-Hemmern können schwere, irreversible und sehr selten tödliche Nebenwirkungen auftreten. Daher ist das frühzeitige Erkennen und eine leitliniengerechte Behandlung dieser Nebenwirkungen wichtig.
- REFERENZEN
- [1] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Patientenleitlinie – Melanom, Eine Leitlinie zur Untersuchung, Behandlung und Nachsorge des schwarzen Hautkrebses, Stand: Mai 2019Letzter Zugriff: 03.09.2020
- [2] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Melanoms, Langversion 3.3, 2020, AWMF Registernummer: 032/024OLLetzter Zugriff: 03.09.2020
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Zielgerichtete Therapie
Zuletzt aktualisiert: 22.04.2025 | Autor(in): Prof. Dr. med. Friedegund Meier, Dr. med. Svea Hüning
Bei ungefähr der Hälfte aller Patientinnen und Patienten mit schwarzem Hautkrebs (= Melanom) liegt eine BRAF-Mutation vor. Das BRAF-Protein ist Bestandteil eines Signalweges, der am normalen Wachstum und Überleben von Zellen beteiligt ist. Eine Veränderung des BRAF-Proteins bewirkt, dass dieser Signalweg ständig aktiviert ist und es zu unkontrolliertem Wachstum der Melanomzellen kommt. BRAF-Hemmer blockieren zielgerichtet das veränderte BRAF-Protein und hemmen damit das unkontrollierte Wachstum der Melanomzellen.
Durch die Einnahme von BRAF-Hemmern konnte eine deutliche Verbesserung des Überlebens gegenüber der Behandlung mit einer Chemotherapie gezeigt werden. Bedauerlicherweise waren die Erfolge durch eine alleinige Behandlung mit BRAF-Hemmern oft sehr kurzlebig, da die Melanomzellen Resistenzmechanismen entwickeln und der Blockade des veränderten BRAF-Proteins und damit des Signalweges ausweichen. Um Resistenzen entgegenzuwirken, werden heutzutage BRAF-Hemmer in der Regel mit MEK-Hemmern kombiniert. MEK-Hemmer blockieren den Signalweg eine Etage unter BRAF. Die Kombination von BRAF- und MEK-Hemmern ist der Einzeltherapie mit BRAF-Hemmern mit einer verlängerten Ansprechdauer und Überlebenszeit überlegen. Dabei ist die Rate an Nebenwirkungen nicht erhöht.
Es werden drei Kombinationen von BRAF- und MEK-Hemmern eingesetzt:
- Vemurafenib + Cobimetinib
- Dabrafenib + Trametinib
- Encorafenib + Binimetinib
Die Wirksamkeit der drei Kombinationen scheint ähnlich zu sein. Die Einnahme aller BRAF-/MEK-Hemmer erfolgt in Tablettenform. Die zielgerichtete Therapie mit BRAF-/MEK-Hemmern führt in der Regel zu einem sehr schnellen und zuverlässigen Therapieansprechen. So erzielt z.B. eine Kombinationstherapie mit Encorafenib und Binimetinib eine Tumorkontrolle bei über 90% der Patientinnen und Patienten, wobei ca. 30% der Patientinnen und Patienten ein Langzeitüberleben erreichen [2]. Die Nebenwirkungen unterscheiden sich leicht zwischen den verschiedenen BRAF-/MEK-Hemmern. So kommt es unter der Therapie mit Vemurafenib und Combimetinib zum Beispiel häufiger zu einer Lichtempfindlichkeit und Hautveränderungen, während eine sehr häufige Nebenwirkung von Dabrafenib und Trametinib Fieber darstellt. Die Nebenwirkungen sind in der Regel gut kontrollierbar und meist nach einer Pausierung der Behandlung rückläufig.
Sehr selten liegt bei Melanomen eine c-KIT-Mutation vor. Insbesondere ist diese Mutation bei Patienten mit akral-lentiginösen (Melanome i.B. der Handinnenflächen, Fußsohlen, Finger, Zehen und unter den Nägeln) und Schleimhautmelanomen nachweisbar. Auch in diesem Fall kann eine Therapie mit einem Signalweg-Hemmer zum Einsatz kommen (siehe Kapitel Schleimhautmelanome).
Weist das Melanom eine BRAF-Mutation auf, stehen somit sowohl Checkpoint-Hemmer (siehe Kapitel Medikamentöse Therapie des metastasierten Melanoms, Stadium IV - Immuntherapie) als auch BRAF- und MEK-Hemmer für eine wirksame Behandlung zur Verfügung.
Welche Therapie bei Ihnen zum Einsatz kommt muss individuell entschieden werden.
Bei einem metastasierten Melanom mit einer BRAF-Mutation kann eine zielgerichtete Therapie mit BRAF-/MEK-Hemmern eingesetzt werden.
Es gibt drei verschiedene Kombinationen von BRAF-/MEK-Hemmern.
Es handelt sich um eine Tablettentherapie.
BRAF-/MEK-Hemmer wirken schnell und zuverlässig und können bei mehr als 30% der Patientinnen und Patienten ein Langzeitüberleben erreichen.
Die Nebenwirkungen sind in der Regel gut kontrollierbar.
- REFERENZEN
- [1] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Patientenleitlinie – Melanom, Eine Leitlinie zur Untersuchung, Behandlung und Nachsorge des schwarzen Hautkrebses, Stand: Mai 2019Letzter Zugriff: 03.09.2020
- [2] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Melanoms, Langversion 3.3, 2020, AWMF Registernummer: 032/024OLLetzter Zugriff: 03.09.2020
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Chemotherapie
Zuletzt aktualisiert: 22.04.2025 | Autor(in): Dr. med. Svea Hüning
Bevor es die Immuntherapie mit Checkpoint-Hemmern und die zielgerichtete Therapie mit Signalweg-Hemmern gab, wurde standardmäßig eine Chemotherapie bei Patientinnen und Patienten mit metastasiertem Melanom durchgeführt. Eine Chemotherapie behindert die Zellteilung und wirkt daher insbesondere auf Zellen, die sich so schnell teilen wie Krebszellen. Chemotherapien sind jedoch nicht sehr selektiv und dadurch werden auch andere, sich schnell teilende, gesunde Zellen angegriffen.
Am häufigsten wurde zur Behandlung des Melanoms in der Vergangenheit als Chemotherapie Dacarbazin (DTIC) angewandt. Es handelt sich hierbei um eine Monochemotherapie, also der Behandlung mit nur einem Medikament. Es gibt jedoch auch bei Chemotherapien Kombinationen verschiedener Präparate. Man spricht dann von einer Polychemotherapie.
Durch die Entdeckung der wirksamen Immun- und zielgerichteten Therapie sind die Chemotherapien in der Behandlung des Melanoms weit in den Hintergrund gerückt. Nur für den Fall, dass die Immun- und zielgerichteten Therapien nicht in Frage kommen oder es unter diesen Therapien zu einem Fortschreiten der Erkrankung kommt, kann von Ihrem Arzt/ Ihrer Ärztin eine Chemotherapie (z.B. Dacarbazin mit einer Ansprechrate von 5-12%) angeboten werden.
Chemotherapien greifen auch gesunde Zellen an.
Chemotherapien sind in der Behandlung des malignen Melanoms weit in den Hintergrund gerückt.
- REFERENZEN
- [1] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Patientenleitlinie – Melanom, Eine Leitlinie zur Untersuchung, Behandlung und Nachsorge des schwarzen Hautkrebses, Stand: Mai 2019Letzter Zugriff: 03.09.2020
- [2] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Melanoms, Langversion 3.3, 2020, AWMF Registernummer: 032/024OLLetzter Zugriff: 03.09.2020
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Studien zur Behandlung des Melanoms
Zuletzt aktualisiert: 23.06.2025 | Autor(in): Dr. med. Svea Hüning
Möglicherweise spricht Ihre behandelnde Ärztin oder Ihr Arzt Sie darauf an, ob Sie an einer klinischen Studie teilnehmen möchten. Solche Studien sind ein wichtiger Bestandteil der medizinischen Forschung – sie helfen, neue Medikamente oder Behandlungsmethoden zu entwickeln und bestehende Therapien weiter zu verbessern.
Warum werden klinische Studien durchgeführt?
Insbesondere bei Patient:innen mit einem fortgeschrittenen Melanom (z. B. Stadium IV) dienen Studien dazu:
- neue oder weiterentwickelte Medikamente auf Wirksamkeit und Sicherheit zu prüfen,
- etablierte Therapien miteinander zu vergleichen,
- bereits bewährte Behandlungen gezielt anzupassen, z. B. um Nebenwirkungen zu reduzieren oder das Ansprechen zu verbessern.
Was sollten Sie vor einer Teilnahme wissen?
Bevor Sie sich für eine Studienteilnahme entscheiden, erhalten Sie eine ausführliche Aufklärung über Ziele, Ablauf, mögliche Risiken und Vorteile. Wichtig ist, dass:
- Ihre Teilnahme freiwillig ist,
- Sie Ihr Einverständnis jederzeit ohne Angabe von Gründen widerrufen können,
- während der Studie möglicherweise häufigere Kontrollen erforderlich sind, um Ihre Sicherheit und den Behandlungserfolg zu gewährleisten.
Ein Vorteil kann sein, dass Sie Zugang zu innovativen Therapien erhalten, die außerhalb der Studie noch nicht verfügbar sind. Es besteht jedoch auch das Risiko unbekannter Nebenwirkungen.
Aktuelle Forschungsschwerpunkte
Es gibt viele neue Ansätze wie personalisiert zugeschnittene Immuntherapien, neuartige Checkpoint-Inhibitoren oder Impfstrategien gegen Melanomzellen, welche sich in frühen Studienphasen befinden.
Die Forschung entwickelt sich schnell – was heute experimentell ist, kann morgen bereits zur Standardbehandlung gehören.
Wo finde ich aktuelle Studien?
Eine Übersicht über laufende Melanom-Studien in Deutschland finden Sie auf der Webseite der Arbeitsgemeinschaft Dermatologische Onkologie (ADO). Dort können Sie gezielt nach Studienstandorten und -inhalten suchen:
Bevor Sie an einer Studie teilnehmen, ist es wichtig, dass Sie von Ihrem Arzt/ Ihrer Ärztin gut über die Studie aufgeklärt werden und Sie für sich selbst zwischen den Vor- und Nachteilen abwägen.
Eine Übersicht über in Deutschland aktuell durchgeführte Studien finden Sie auf der Internetseite der Arbeitsgemeinschaft Dermatologischer Onkologie (ADO).
- REFERENZEN
- [1] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Patientenleitlinie – Melanom, Eine Leitlinie zur Untersuchung, Behandlung und Nachsorge des schwarzen Hautkrebses, Stand: Mai 2019Letzter Zugriff: 03.09.2020
- [2] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Melanoms, Langversion 3.3, 2020, AWMF Registernummer: 032/024OLLetzter Zugriff: 03.09.2020
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Intraläsionale Tumortherapie
Zuletzt aktualisiert: 13.01.2025 | Autor(in): Viola K. DeTemple
Was bedeutet „intraläsionale Therapie”?
Eine intraläsionale Therapie ist eine Therapieform, bei der Medikamente oder Substanzen in (= „intra") ein bösartig verändertes Areal (= „Läsion") eingebracht werden. Dadurch kommt es zu deutlich weniger Nebenwirkungen als bei einer systemischen Therapie. Voraussetzung für eine solche Therapie ist eine gute Zugänglichkeit des veränderten Areals (in der Regel an der Haut). Oftmals wird eine intraläsionale Therapie angewendet, wenn eine operative Entfernung nicht (mehr) angezeigt ist [1-3]. In manchen Fällen kann eine intraläsionale Therapie zudem sogenannte abskopale Effekte haben. Das bedeutet, dass durch die Aktivierung des Immunsystems ein positiver Effekt auf die gesamte Krebserkrankung zu verzeichnen ist, obwohl nur einzelne Hautläsionen behandelt werden.
Für welche Hautkrebsarten gibt es intraläsionale Therapieoptionen?
Für verschiedene Hautkrebsarten gibt es teilweise in Deutschland zugelassene, teilweise erst experimentelle intraläsionale Therapiemöglichkeiten. Einige langjährig angewandte intraläsionale Therapien wurden zwischenzeitlich aufgrund verträglicherer und wirksamerer Alternativen verlassen [1; 4].
Gerade im Bereich des malignen Melanoms (= schwarzer Hautkrebs) gibt es sehr gute klinische Daten auch im Rahmen von Studien, die beispielsweise zur Zulassung von T-VEC in Deutschland geführt haben. Diese intraläsionale Therapieoption kann auch beim Merkelzell-Karzinom angewendet werden, hier aber im „off-label-use" (= nicht zugelassen). Erfahrungen mit anderen intraläsionalen Therapien gibt es auch für den weißen Hautkrebs (z.B. Basalzellkarzinom / Plattenepithelkarzinom), hier ebenfalls ohne Zulassung.
Intraläsionale Therapieoptionen
- Talimogene laherparepvec (T-VEC)
Bei der seriellen Therapie (= mehrere Injektionen) mit T-VEC („Talimogene laherparepvec") werden genetisch veränderte Herpes-Viren (HSV-1) in den Tumor gespritzt. Diese veränderten Viren vermehren sich bevorzugt in Krebszellen, wodurch diese gezielt zerstört werden („onkolytisch"). Zusätzlich werden immunaktivierende Faktoren (GM-CSF) ausgeschüttet, die dazu führen, dass auch nicht behandelte Metastasen (= Tumorabsiedelungen) an Größe abnehmen können („abskopaler Effekt").
Zu den Nebenwirkungen dieser im Allgemeinen sehr gut verträglichen Therapie gehören Fieber, Schüttelfrost und Müdigkeit sowie örtliche Reaktionen an der Injektionsstelle.
Zugelassen ist die intraläsionale T-VEC-Therapie für örtliche oder entfernte Metastasen des nicht operablen malignen Melanoms (= schwarzer Hautkrebs) [1; 4-6]. Zusätzlich wird T-VEC für das nicht operable Merkelzell-Karzinom diskutiert [3; 7].
- Elektrochemotherapie (ECT)
Die Elektrochemotherapie ist eine Kombination aus einer systemischen und/oder örtlichen Chemotherapiegabe (i.d.R. Bleomycin oder Cisplatin). Hierbei wird das Chemotherapeutikum unter Stromimpulsen in bösartige Hautveränderungen eingebracht, indem elektrische Sonden kurzzeitig in den Tumorbereich eingestochen werden. Die Stromimpulse führen dazu, dass die Zellmembranen der Krebszellen durchlässiger werden, und die Wirkstoffe besser in die Krebszellen eindringen können. Die Chemotherapie hemmt in den Krebszellen die Zellteilung („zytostatisch"). Infolgedessen kommt es zu einer örtlichen Zerstörung der Metastasen.
Zumeist wird eine Elektrochemotherapie unter Sedierung oder in Allgemeinanästhesie durchgeführt, da durch die Stromimpulse unangenehme Muskelzuckungen auftreten können. Im Nachgang kann es zu Wundschmerzen kommen.
Die im Vergleich zu anderen intraläsionalen Therapieoptionen technisch aufwendige Elektrochemotherapie ist v.a. für In-transit-Metastasen (= Tumorabsiedelungen, die entlang der abfließenden Lymphbahnen auftreten) des malignen Melanoms geeignet. Eine Zulassung besteht derzeit nicht [1;4].
- 5-Fluorouracil (5-FU)
5-Fluorouracil (5-FU) gehört zu der Gruppe der Zytostatika, also zu den Arzneistoffen, die die Zellvermehrung hemmen. Neben der topischen Applikation (= der Arzneistoff wird auf das betroffene Areal aufgetragen) auf Krebsvorläuferläsionen kann es auch in niedrig-Risiko-Tumore eingespritzt werden. Hierbei kommt es häufig zu Reaktionen an der Injektionsstelle.
Die intraläsionale Injektion von 5-FU ist bei niedrig-Risiko-Basalzellkarzinomen erprobt. Bislang besteht jedoch keine Zulassung [2;8;9].
- Intraläsionale Kryotherapie
Bei der Kryotherapie („cryo" = Kälte) wird Kälte zur Zerstörung von Tumorzellen genutzt. Hierzu wird die Läsion mit speziell gefertigten Sonden durchstochen und Kälte in Form von flüssigem Stickstoff durch das Tumorareal geleitet. Die extreme Kälte führt zu einem Absterben der Zellen in dem behandelten Areal. Abgesehen von leichten örtlichen Reaktionen ist eine sehr gute Verträglichkeit beschrieben.
Die intraläsionale Kryotherapie kann insbesondere bei betagteren Patientinnen und Patienten als Alternative zur operativen Therapie bei Basalzellkarzinomen in Frage kommen. In kleineren Patientengruppen zeigte sich ein hervorragendes Ansprechen bereits nach einmaliger Anwendung. Eine Zulassung besteht derzeit nicht [2;10].
In der nachfolgenden Tabelle sind die aktuell bekanntesten Behandlungsmöglichkeiten nochmals zusammengefasst:
Intraläsionale Therapieoption Einsatzbereich Wirkweise Erfolgsaussichten Nebenwirkungen Talimogene laherparepvec (T-VEC; IMLYGIC®) 1. malignes Melanom (zugelassen)
2. Merkelzell-Karzinom (off-label)Onkolytische Immuntherapie 1. Malignes Melanom: 26-64% Ansprechen;
34% Ansprechen von nicht behandelten Metastasen;
16% vollständige Abheilung
2. Merkelzell-Karzinom: unzureichende DatenlageMüdigkeit, Fieber, Schüttelfrost, Reaktionen an der Injektionsstelle Elektrochemo-Therapie (ECT) malignes Melanom (off-label) Zytostatische Tumorzerstörung 56-85% Ansprechen;
56-72% vollständige Abheilung;
34% Ansprechen von nicht behandelten MetastasenMuskelzucken während der Therapie, Wundschmerz 5-Fluorouracil (5-FU) Basalzell-/ Plattenepithel-Karzinom (off-label) Zytostatische Tumorzerstörung 79-100% Ansprechen (in kleinen Patienten-Gruppen) Reaktionen an der Injektionsstelle Intraläsionale Kryotherapie Basalzellkarzinom (off-label) Tumorzerstörung durch Kälte bis zu 100% Ansprechen nach einmaliger Applikation (in kleinen Patienten-Gruppen) Örtliche Reaktionen
Manche nicht (mehr) operierbare Hauttumore können auch mit Substanzen behandelt werden, die direkt in das Tumorgewebe eingebracht werden („intraläsionale Therapie“).
Es gibt gute Erfahrungswerte zu intraläsionalen Therapien v.a. für das maligne Melanom, das Merkelzell-Karzinom oder das Basalzellkarzinom.
T-VEC ist die bislang einzige zugelassene intraläsionale Therapie; sie wird beim malignen Melanom eingesetzt
- REFERENZEN
- [1] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Melanoms, Langversion 3.3, 2020, AWMF Registernummer: 032/024OL, http://www.leitlinienprogramm-onkologie.de/leitlinien/melanom/ (abgerufen am: 01.03.2022)
- [2] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): S2k-Leitlinie Basalzellkarzinom der Haut (Aktualisierung 2023), Langfassung, Stand 01.01.2024, Version 9.0, AWMF Registernummer: 032-021
- [3] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): 2k - Leitlinie - Merkelzellkarzinom (MZK, MCC, neuroendokrines Karzinom der Haut) – Update 2018, Langfassung, 2018, AWMF Registernummer: 032 – 023 (abgerufen am: 01.03.2022)
- [4] Henderson MA. Topical and intralesional therapies for in-transitmelanoma. Melanoma Manag. 2019;6(3):MMT23. Published 2019 Sep 2. doi:10.2217/mmt-2019-0008
- [5] Vidovic D, Giacomantonio C. Insights into the Molecular Mechanisms Behind Intralesional Immunotherapies for Advanced Melanoma. Cancers (Basel). 2020;12(5):1321. Published 2020 May 22. doi:10.3390/cancers12051321
- [6] Ferrucci PF, Pala L, Conforti F, Cocorocchio E. Talimogene Laherparepvec (T-VEC): An Intralesional Cancer Immunotherapy for Advanced Melanoma. Cancers (Basel). 2021;13(6):1383. Published 2021 Mar 18. doi:10.3390/cancers13061383
- [7] Nguyen MHK, Leong SP, Abendroth R, Kashani-Sabet M, Kim KB. Complete clinical response to intralesional talimogene laherparepvec injection in a patient with recurrent, regionally advanced Merkel cell carcinoma. JAAD Case Rep. 2019;5(10):849-851. Published 2019 Sep 24. doi:10.1016/j.jdcr.2019.07.006
- [8] Sakhiya J, Sakhiya D, Kaklotar J, et al. Intralesional Agents in Dermatology: Pros and Cons. J Cutan Aesthet Surg. 2021;14(3):285-295. doi:10.4103/JCAS.JCAS_109_20
- [9] Thomson J, Hogan S, Leonardi-Bee J, Williams HC, Bath-Hextall FJ. Interventions for basal cell carcinoma of the skin. Cochrane Database Syst Rev. 2020;11(11):CD003412. Published 2020 Nov 17. doi:10.1002/14651858.CD003412.pub3
- [10] Har-Shai Y, Sommer A, Gil T et al. Intralesional cryosurgery for the treatment of basal cell carcinoma of the lower extremities in elderly subjects: a feasibility study. International Journal of Dermatology 2016; 55: 342-350
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Strahlentherapie
Zuletzt aktualisiert: 22.04.2025 | Autor(in): Prof. Dr. med. Friedegund Meier
Wenn bei der Operation Lymphknoten entfernt werden müssen und bestimmte Risikofaktoren für einen Krankheitsrückfall vorliegen, wird empfohlen, nach dem Eingriff zusätzlich eine Strahlentherapie durchzuführen. Bei diesen Risikofaktoren handelt es sich um:
- 3 oder mehr befallene Lymphknoten
- Lymphknotenmetastasen, die größer als 3cm sind
- Durchbruch der Bindegewebskapsel, welche den Lymphknoten umgibt
- erneute Metastasierung in einer Region mit bereits entfernten Lymphknoten
Die adjuvante Strahlentherapie wirkt örtlich, also genau dort, wo die operativ entfernten Lymphknoten bzw. Metastasen waren. Durch die Therapie kann das lokale (örtliche) Rückfallrisiko gesenkt werden. Eine adjuvante Strahlentherapie kann Nebenwirkungen haben, wie z. B. ein Lymphödem (Lymphstau).
Medikamente
- Immuntherapie mit PD-1 Hemmern
Ziel der Immuntherapie ist es, das körpereigene Immunsystem in die Lage zu versetzen, sich selbst gegen Krebszellen zu wehren. Genauere Informationen zur Wirkungsweise von PD-1 Hemmern finden Sie im Kapitel „Wirkmechanismen“.
Was kann man mit PD-1-Hemmern erreichen?
Für Patienten mit einem Melanom im Stadium IIB oder IIC wurde eine Studie nach operativer Entfernung des Melanoms mit tumorfreiem Wächterlymphknotenbefund durchgeführt (J Clin Oncol 40, 2022 (suppl 17; abstr LBA9500). Die Patienten erhielten den PD-1-Hemmer Pembrolizumab oder ein Scheinmedikament für ein Jahr. Mit Pembrolizumab konnte das Rückfallrisiko bzw. das Risiko für eine Fernmetastasierung um 36% gesenkt werden. Für Pembrolizumab im Stadium II liegen noch keine Daten für eine Lebensverlängerung vor.
In Studien, in denen Patienten mit einem Melanom im Stadium III oder IV nach der Operation mit PD-1-Hemmern behandelt wurden, konnte im Vergleich zu einer Behandlung mit einem Scheinmedikament (Placebo) das Risiko für einen Rückfall um ca. 40 % gesenkt werden. Derzeit ist der PD-1-Hemmer Pembrolizumab für die adjuvante Therapie des Melanoms im Stadium IIB/C und III zugelassen, während der PD-1-Hemmer Nivolumab für die adjuvante Therapie des Melanoms im Stadium III und IV zugelassen ist. Auf dem europäischen Krebskongress (ESMO) 2021 wurden [MF2] aktualisierte Studiendaten vorgestellt. 50% der Patienten, die ein Jahr mit dem PD-1-Hemmer Nivolumab behandelt worden waren, hatten innerhalb von fünf Jahren keinen Rückfall erlebt. Ebenso hatten mehr als 60% der Patienten, die ein Jahr mit dem PD-1-Hemmer Pembrolizumab behandelt worden waren, innerhalb von drei Jahren keinen Rückfall erlebt, während über 40% der Patienten, die keine adjuvante Behandlung mit einem PD-1 Hemmer erhalten hatten, ebenfalls innerhalb von drei Jahren keinen Rückfall hatten. Bislang liegen noch keine Ergebnisse dazu vor, ob die Therapie auch das Leben der Patienten insgesamt verlängern kann.
Vor kurzem wurden die Daten einer klinischen Studie von Melanom-Patienten mit Fernmetastasen veröffentlicht, die nach einer Operation oder nach einer Strahlentherapie der Metastasen die Kombination Nivolumab plus Ipilimumab als adjuvante Therapie erhalten hatten. 70% der Patienten, die ein Jahr mit dieser Kombination behandelt worden waren, hatten innerhalb von zwei Jahren keinen Rückfall erlebt. Im Vergleich dazu hatten nur etwas mehr als 40% der Patienten, die für ein Jahr allein mit Nivolumab behandelt worden waren, innerhalb von zwei Jahren keinen Rückfall. Demgegenüber waren nur 14% der Patienten, die weder Nivolumab plus Ipilimumab noch Nivolumab allein erhalten hatten, nach zwei Jahren noch rückfallfrei. Allerdings entwickelten über 70% der Patienten unter Therapie mit Nivolumab plus Ipilimumab schwere Nebenwirkungen. Die Kombination Nivolumab plus Ipilimumab ist aktuell nicht für die adjuvante Therapie des Melanoms zugelassen. [1-7]
Welche Nebenwirkungen können auftreten?
In der Regel werden PD-1-Hemmer gut vertragen. Nebenwirkungen werden in erster Linie dadurch hervorgerufen, dass die Wirkstoffe das Immunsystem aktivieren – was für die Tumorabwehr erwünscht ist (siehe Kapitel „Wirkmechanismen“). Nebenwirkungen können in allen Organen auftreten, wie z. B. Darm, Leber, Lunge, Nieren und Hormondrüsen. Die häufigsten Beschwerden sind Erschöpfung, Hautausschlag, Juckreiz, Durchfall und Übelkeit. Bei etwa 15 % der Patienten treten schwere Nebenwirkungen auf und etwa 10% der Patienten brechen die Therapie aufgrund schwerer Nebenwirkungen ab. In der Regel klingen Nebenwirkungen bei frühzeitiger Behandlung rasch ab (siehe Kapitel „Nebenwirkungen“). Aus diesem Grund sollten Patienten körperliche Veränderungen und Beschwerden sobald wie möglich ihrem/r behandelnden/r Arzt/Ärztin melden. In seltenen Fällen können dauerhafte Nebenwirkungen auftreten, wie zum Beispiel eine Entzündung und daraus folgend der Funktionsverlust von Hormondrüsen wie der Schilddrüse. In diesem Fall ist eine tägliche Hormonersatztherapie in Form von Tabletten notwendig. Wenn sich unter der Therapie der sehr seltene Fall eines Diabetes mellitus (Zuckerkrankheit) entwickelt, bildet sich auch dieser in der Regel nicht mehr zurück und muss dauerhaft behandelt werden. [2-6]
Wie werden PD-1-Hemmer angewendet?
PD-1-Hemmer werden ein Jahr lang als Infusion über eine Dauer von 30 bis 60 Minuten verabreicht. Zwischen den Medikamentengaben liegen zwei bis mehrere Wochen.
- Zielgerichtete Therapie mit BRAF-/MEK Hemmern
Bei etwa jedem zweiten Melanom wird im BRAF-Gen eine Mutation (Veränderung) gefunden, die BRAFV600-Mutation. Das veränderte BRAF-Protein trägt zusammen mit dem nachgeschalteten MEK-Protein dazu bei, dass die Signalübertragungskette BRAF-MEK-ERK in der Melanomzelle ständig aktiviert ist und damit das Melanom bzw. die Melanommetastasen ständig wächst bzw. wachsen. Die BRAF- und MEK-Proteine können gezielt mit BRAF-/MEK-Hemmern ausgeschaltet werden. Werden diese gemeinsam eingenommen, können sie das unkontrollierte Wachstum der Melanomzellen aufhalten.
BRAF-Mutation, ja oder nein? Ein Test findet es heraus
Bei jedem Patienten mit einem Melanom ab Stadium III sollte deshalb getestet werden, ob in dem entfernten Tumorgewebe BRAF-Mutationen zu finden sind. Studien zeigen, dass eine BRAF-Mutation bei etwa 50-60% der Melanom-Patienten im fortgeschrittenen Stadium vorliegt. Wenn dies der Fall ist, kann neben der oben beschriebenen Immuntherapie mit PD-1-Hemmern auch eine zielgerichtete Therapie mit BRAF-/MEK-Hemmern angewendet werden.
Was kann man mit BRAF-/MEK-Hemmern erreichen?
Eine klinische Studie hat gezeigt, dass eine adjuvante Therapie mit den BRAF-/MEK-Hemmern Dabrafenib plus Trametinib bei Patienten mit Melanom im Stadium III im Vergleich zu einer Behandlung mit einem Scheinmedikament (Placebo) das Risiko für einen Rückfall um mehr als die Hälfte (>50 %) senken kann. Auch das Risiko, aufgrund des Melanoms zu sterben, war in dieser Studie um 40 % geringer als ohne Therapie. Auf dem amerikanischen Krebskongress (ASCO) 2020 wurden aktualisierte Studiendaten vorgestellt. Über die Hälfte der Patienten (>50 %), die ein Jahr mit den BRAF-/MEK-Hemmern Dabrafenib plus Trametinib behandelt wurden, hatten innerhalb von fünf Jahren keinen Rückfall erlebt, während 36% der Patienten, die eine adjuvante Behandlung mit einem Scheinmedikament erhalten hatten, innerhalb von fünf Jahren keinen Rückfall hatten. [8,9]
Welche Nebenwirkungen können auftreten?
Die häufigsten Nebenwirkungen sind Fieber, Schüttelfrost, Kopfschmerzen, Erschöpfung und Übelkeit. Bei 41 % der Patienten treten schwere Nebenwirkungen auf (meistens Fieber). Etwa 25% der Patienten brachen die Therapie aufgrund von Nebenwirkungen wie Fieber, Bluthochdruck, Erschöpfung oder Anstieg der Leberwerte ab. [8]
In der Regel können die Nebenwirkungen gut behandelt werden (siehe Kapitel „Nebenwirkungen“) und klingen nach Beendigung der Therapie vollständig ab. In sehr seltenen Fällen können sie dauerhaft sein, wie z.B. Herzschwäche. Vor Beginn der Therapie muss unter anderem abgeklärt werden, ob eine Herzerkrankung vorliegt, die eine Therapie mit BRAF-/MEK-Hemmern nicht zulässt oder besondere Vorsicht erfordert.
Wie wird die zielgerichtete Therapie angewendet?
Bei der adjuvanten Therapie mit den BRAF-/MEK Hemmern Dabrafenib plus Trametinib handelt es sich um zwei verschiedene Arten von Tabletten, die täglich über die Dauer von einem Jahr eingenommen werden.
- Welche adjuvante Therapie ist für mich geeignet?
Ob eine adjuvante medikamentöse Therapie für Sie empfehlenswert ist und welche medikamentöse Therapie in Ihrem individuellen Fall am besten geeignet ist, hängt von verschiedenen Faktoren ab. Hierfür muss man das Tumorstadium und das Risiko für einen Rückfall kennen (s. NVKH Entscheidungshilfe). Weiterhin muss man wissen, ob das Melanom eine BRAF-Mutation hat, aber auch, welche Erkrankungen bei Ihnen bereits vorliegen. Auch die möglichen Nebenwirkungen sollten u.a. auch vor dem Hintergrund der bekannten Vorerkrankungen bedacht werden. Zum Beispiel muss bei schwerwiegenden Autoimmunerkrankungen, wie chronisch-entzündlichen Darmerkrankungen, im Einzelfall abgewogen werden, ob die Vorteile einer Immuntherapie mit PD-1-Hemmern tatsächlich überwiegen. Ihr(e) betreuende(r) Arzt/Ärztin wird Nutzen und Risiken einer adjuvanten medikamentösen Therapie mit Ihnen besprechen und auch Ihre Wünsche berücksichtigen.
Allen Patienten im Stadium IIB, IIC, III und IV soll nach der vollständigen operativen Entfernung des Melanoms und der Metastasen eine adjuvante medikamentöse Therapie angeboten werden. Dies kann eine zielgerichtete Therapie mit BRAF-/MEK-Hemmern oder eine Immuntherapie mit einem PD-1-Hemmer sein. Welche gewählt wird, hängt von verschiedenen Faktoren ab, die Ihr betreuender Arzt/Ärztin Ihnen erläutern wird.
Für die Auswahl der bestmöglichen Therapie müssen Faktoren wie Tumorstadium, Rezidivrisiko (Rückfallrisiko), Mutation des Tumors, Vorerkrankungen und Nebenwirkungen berücksichtigt werden.
- REFERENZEN
- [1] Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Melanoms. Die S3-Leitlinie wurde überarbeitet und um das neue Kapitel „Adjuvante Therapie“ ergänzt.
- [2] Eggermont AM et al. Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med 2018;378:1789-1801
- [3] Eggermont AMM et al. Prognostic and predictive value of AJCC-8 staging in the phase III EORTC1325/KEYNOTE-054 trial of pembrolizumab vs placebo in resected high-risk stage III melanoma. Eur J Cancer. 2019;116:148–157
- [4] Weber J et al. Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med. 2017;377:1824–1835
- [5] Ascierto PA,…Weber J. Adjuvant nivolumab versus ipilimumab in resected stage IIIB–C and stage IV melanoma (CheckMate 238): 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial. Lancet Oncol 2020
- [6] A. M. Eggermont, ‘Pembrolizumab versus placebo after complete resection of high-risk stage III melanoma: New recurrence-free survival results from the EORTC 1325-MG/Keynote 054 double-blinded phase III trial at three-year median follow-up.’, J Clin Oncol 38: 2020 (suppl; abstr 10000).
- [7] Zimmer L, Livingstone E, et al. Adjuvant nivolumab plus ipilimumab or nivolumab monotherapy versus placebo in patients with resected stage IV melanoma with no evidence of disease (IMMUNED): a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet 2020; 395:1558-68
- [8] G. V. Long et al., ‘Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma’, N. Engl. J. Med., vol. 377, no. 19, pp. 1813–1823, 09 2017.
- [9] A. Hauschild, ‘Long-term benefit of adjuvant dabrafenib + trametinib (D+T) in patients (pts) with resected stage III BRAF V600–mutant melanoma: Five-year analysis of COMBI-AD.’, J Clin Oncol 38: 2020 (suppl; abstr 10001).
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Link copied to clipboard!