Atypisches Fibroxanthom und Pleomorphes Dermales Sarkom
Zuletzt aktualisiert: 14.01.2026 | Autor(in): Doris Helbig, Mirjana Ziemer
Verbreitung und Ursachen
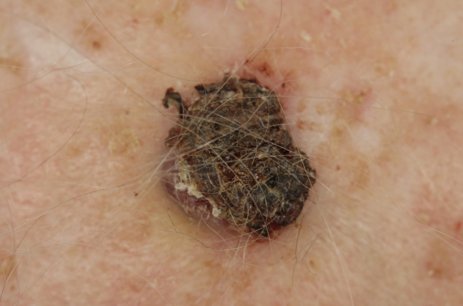
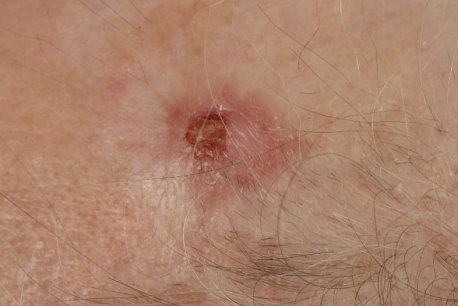
Das atypische Fibroxanthom (AFX) und das pleomorphe dermale Sarkom (PDS) sind Spektren einer seltenen bösartigen Erkrankung der Haut. Genaue Daten zur Häufigkeit gibt es nicht. Die Diagnose des AFX wurde erstmal in den 1960er-Jahren beschrieben.
Über den Ursprung der Tumorzellen wird seit Erstbeschreibung diskutiert. Das liegt nicht zuletzt auch daran, dass in den zurückliegenden Jahrzehnten irrtümlich andere mikroskopisch ähnliche Tumoren als AFX oder PDS diagnostiziert wurden. Wahrscheinlich ist ein Ursprung aus den Bindegewebszellen, diskutiert werden auch Plattenepithelzellen der Haut.
Der Begriff PDS wird für Tumoren verwendet, die mikroskopisch dem AFX entsprechen. Allerdings erfassen diese Tumoren Anteile des tiefer gelegenen Unterhautfettgewebes und weisen nekrotische (=abgestorben) Tumoranteile und/oder eine Ausbreitung entlang von Nerven oder in Gefäßen auf. Als Risikofaktoren sind UV-Licht, radioaktive Strahlung, eine Immunsuppression (=Unterdrückung des körpereigenen Abwehrsystems) und genetische Erkrankungen (z.B. vererbte Defekte der DNA-Reparaturmechanismen, die verhindern, dass Schäden der Haut durch Sonneneinstrahlung regenerieren können) beschrieben.
Das atypische Fibroxanthom (AFX) und das pleomorphe dermale Sarkom (PDS) sind seltene bösartige Tumoren der Haut.
Sie unterscheiden sich im Wesentlichen durch ihre Tiefenausdehnung und das Vorliegen von Tumornekrosen (=abgestorbene Tumoranteile), Nerven-oder Gefäßausbreitung beim PDS.
- REFERENZEN
- Koelsche C, Stichel D, Griewank KG, Schrimpf D, Reuss DE, Bewerunge-Hudler M, et al. Genome-wide methylation profiling and copy number analysis in atypical fibroxanthomas and pleomorphic dermal sarcomas indicate a similar molecular phenotype. Clin Sarcoma Res. 2019;9:2.
- Helwig EB, May D. Atypical fibroxanthoma of the skin with metastasis. Cancer. 1986;57(2):368-76.
- Mentzel T, Requena L, Brenn T. Atypical Fibroxanthoma Revisited. Surg Pathol Clin. 2017;10(2):319-35.
- Dei Tos AP, Maestro R, Doglioni C, Gasparotto D, Boiocchi M, Laurino L, et al. Ultraviolet-induced p53 mutations in atypical fibroxanthoma. Am J Pathol. 1994;145(1):11-7.
- Persa OD, Loquai C, Wobser M, Baltaci M, Dengler S, Kreuter A, et al. Extended surgical safety margins and ulceration are associated with an improved prognosis in pleomorphic dermal sarcomas. J Eur Acad Dermatol Venereol. 2019.
- Bitel A, Schonlebe J, Kronert C, Wollina U. Atypical fibroxanthoma: An analysis of 105 tumors. Dermatol Ther. 2020:e13962.
- Miller K, Goodlad JR, Brenn T. Pleomorphic dermal sarcoma: adverse histologic features predict aggressive behavior and allow distinction from atypical fibroxanthoma. Am J Surg Pathol. 2012;36(9):1317-26.
- Tolkachjov SN, Kelley BF, Alahdab F, Erwin PJ, Brewer JD. Atypical fibroxanthoma: Systematic review and meta-analysis of treatment with Mohs micrographic surgery or excision. J Am Acad Dermatol. 2018;79(5):929-34 e6.
- Tardio JC, Pinedo F, Aramburu JA, Suarez-Massa D, Pampin A, Requena L, et al. Pleomorphic dermal sarcoma: a more aggressive neoplasm than previously estimated. J Cutan Pathol. 2016;43(2):101-12.
- Klein S, Persa OD, Mauch C, Noh KW, Pappesch R, Wagener-Ryczek S, et al. First report on two cases of pleomorphic dermal sarcoma successfully treated with immune checkpoint inhibitors. Oncoimmunology. 2019;8(12):e1665977.
- Klein S, Mauch C, Wagener-Ryczek S, Schoemmel M, Buettner R, Quaas A, et al. Immune-phenotyping of pleomorphic dermal sarcomas suggests this entity as a potential candidate for immunotherapy. Cancer Immunol Immunother. 2019.
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Symptome von Sarkomen und seltenen Tumoren der Haut
Zuletzt aktualisiert: 14.01.2026 | Autor(in): Doris Helbig, Mirjana Ziemer
AFX und PDS treten typischerweise an Körperstellen auf, die über längere Zeit dem Licht ausgesetzt sind. Hierzu gehören am häufigsten der behaarte Kopf und das Gesicht. Es sind meist haut- bis fleischfarbene feste Knoten, die bis zu mehreren Zentimetern groß und ulzeriert (=geschwürig) sein können. Das Tumorwachstum variiert zwischen wenigen Wochen bis mehreren Monaten, wobei PDS oftmals über einen längeren Zeitraum entstehen. Der Altersgipfel bei Erstdiagnose liegt bei Patienten im 7. bis 8. Lebensjahrzehnt. Es sind überwiegend Männer betroffen. Bei Patienten mit Immunsuppression (=Unterdrückung des körpereigenen Abwehrsystems) oder speziellen genetischen Erkrankungen ist ein Auftreten bereits in früherem Alter möglich.
Die Prognose von AFX und PDS ist von der Eindringtiefe, der Beteiligung tiefliegender Strukturen sowie der Ausbreitung entlang von Nerven oder in Gefäße abhängig.
Bei AFX kann nach vollständiger chirurgischer Entfernung von einer Heilung ausgegangen werden. Das ist insbesondere dann der Fall, wenn mittels sogenannter mikroskopisch kontrollierter Chirurgie (MKC) operiert wurde. Bei der MKC werden die Schnittränder unter dem Mikroskop lückenlos geprüft. Sollten zu einer Seite Tumorausläufer in den Schnittrand reichen, kann am nächsten Tag nach der Operation an dieser Stelle nachgeschnitten werden. So kann gewebesparend operiert werden und ein Rückfall weitgehend verhindert werden. Bei PDS hingegen sind Rückfälle (=Rezidive) beschrieben, wobei diese in der Regel innerhalb der ersten beiden Jahre nach Erstoperation auftreten. Bei Entfernung mit einem Sicherheitsabstand von 2 cm ist das Rückfallrisiko auch bei PDS gering. Eine Metastasierung ist beim PDS möglich. Die Metastasierung erfolgt vor allem in die Haut und die Lymphknoten der Tumorregion, seltener kommt es zu Fernmetastasen, zum Beispiel in der Lunge. Patienten mit begleitenden Blutkrebserkrankungen scheinen dabei häufiger betroffen zu sein.
- REFERENZEN
- Koelsche C, Stichel D, Griewank KG, Schrimpf D, Reuss DE, Bewerunge-Hudler M, et al. Genome-wide methylation profiling and copy number analysis in atypical fibroxanthomas and pleomorphic dermal sarcomas indicate a similar molecular phenotype. Clin Sarcoma Res. 2019;9:2.
- Helwig EB, May D. Atypical fibroxanthoma of the skin with metastasis. Cancer. 1986;57(2):368-76.
- Mentzel T, Requena L, Brenn T. Atypical Fibroxanthoma Revisited. Surg Pathol Clin. 2017;10(2):319-35.
- Dei Tos AP, Maestro R, Doglioni C, Gasparotto D, Boiocchi M, Laurino L, et al. Ultraviolet-induced p53 mutations in atypical fibroxanthoma. Am J Pathol. 1994;145(1):11-7.
- Persa OD, Loquai C, Wobser M, Baltaci M, Dengler S, Kreuter A, et al. Extended surgical safety margins and ulceration are associated with an improved prognosis in pleomorphic dermal sarcomas. J Eur Acad Dermatol Venereol. 2019.
- Bitel A, Schonlebe J, Kronert C, Wollina U. Atypical fibroxanthoma: An analysis of 105 tumors. Dermatol Ther. 2020:e13962.
- Miller K, Goodlad JR, Brenn T. Pleomorphic dermal sarcoma: adverse histologic features predict aggressive behavior and allow distinction from atypical fibroxanthoma. Am J Surg Pathol. 2012;36(9):1317-26.
- Tolkachjov SN, Kelley BF, Alahdab F, Erwin PJ, Brewer JD. Atypical fibroxanthoma: Systematic review and meta-analysis of treatment with Mohs micrographic surgery or excision. J Am Acad Dermatol. 2018;79(5):929-34 e6.
- Tardio JC, Pinedo F, Aramburu JA, Suarez-Massa D, Pampin A, Requena L, et al. Pleomorphic dermal sarcoma: a more aggressive neoplasm than previously estimated. J Cutan Pathol. 2016;43(2):101-12.
- Klein S, Persa OD, Mauch C, Noh KW, Pappesch R, Wagener-Ryczek S, et al. First report on two cases of pleomorphic dermal sarcoma successfully treated with immune checkpoint inhibitors. Oncoimmunology. 2019;8(12):e1665977.
- Klein S, Mauch C, Wagener-Ryczek S, Schoemmel M, Buettner R, Quaas A, et al. Immune-phenotyping of pleomorphic dermal sarcomas suggests this entity as a potential candidate for immunotherapy. Cancer Immunol Immunother. 2019.
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Behandlung von Sarkomen und seltenen Tumoren der Haut
Zuletzt aktualisiert: 14.01.2026 | Autor(in): Doris Helbig, Mirjana Ziemer
Therapie
Für das AFX und das PDS soll unter heilender Absicht (=kurativer Intention) eine komplette operative Entfernung mit anschließender feingeweblicher (mikroskopischer) Untersuchung erfolgen. Wenn möglich soll eine sogenannte mikrographisch kontrollierte Exzision (MKC) erfolgen, sowie ein entsprechender Sicherheitsabstand zum Tumorrand eingehalten werden.
Beim AFX ist eine mikrographisch (also per Mikroskopie) kontrollierte Resektion knapp im Gesunden ausreichend. Im Falle des PDS sollte der Sicherheitsabstand auf bis zu 2 cm erweitert werden, um das Risiko eines erneuten lokalen Wachstums des Tumors (=Rückfallrisiko) zu senken. Dabei müssen anatomische, funktionelle und ästhetische Aspekte vor allem im Gesicht berücksichtigt werden, da bei Operationen mit großen Sicherheitsabständen Einbußen in der Funktion der Körperregion (z.B. Einschränkung der Mimik, Mundöffnung oder Lidschluss) oder der ästhetischen Gesichtsform (Veränderung der Gesichtsform, Asymmetrie der Gesichtshälften, veränderte Gesichtsproportionen) drohen. Die endgültige Entscheidung für abweichende Sicherheitsabstände sollte der Operateur im Einverständnis mit dem informierten Patienten treffen, auch in Abhängigkeit der speziellen Lage des Tumors.
PDS sind seltene Hauttumoren und daher wird empfohlen, diese im interdisziplinären Hauttumorboard zu besprechen, unabhängig vom Stadium. Bei Patienten mit dieser seltenen Erkrankung sollte die Behandlung in einem zertifizierten Hautkrebszentrum durchgeführt werden. Informationen zu einem zertifizierten Hautkrebszentrum in Ihrer Nähe finden Sie unter https://www.oncomap.de/.
Es gibt keine publizierten Daten zur Empfindlichkeit von AFX/PDS auf eine Bestrahlungsbehandlung. Ist jedoch eine vollständige Operation des Tumors nicht möglich, kann eine Nachbestrahlung des Resttumorareals erwogen werden. Eventuell besteht auch ein Nutzen einer Nachbestrahlung bei vollständig operierten PDS zur Vorbeugung eines erneuten Tumorwachstums
Therapie mit Medikamenten
Eine wirksame Standardtherapie mit Medikamenten fortgeschrittener AFX/PDS ist nicht bekannt. Therapieempfehlungen für nicht operierbare oder metastasierte Patienten sollten im Rahmen eines interdisziplinären Tumorboards individuell besprochen werden. In die Entscheidung könnten neben den klinischen Aspekten (=Beschwerden, erkennbare Symptome), Ergebnisse molekulargenetischer Untersuchungen und mikroskopische Tumoreigenschaften einfließen.
Es gibt vereinzelte Berichte über Behandlungsversuche mit verschiedenen Chemotherapien. Auch kann eine immunmodulierende Therapie mit einem sogenannten Checkpointinhibitor wie z.B. einem anti-PD-1 Antikörper erwogen werden. Jedoch sind diese Therapien nicht für das AFX / PDS zugelassen und erfordern deshalb eine vorherige Klärung der Kostenübernahme durch die Krankenkasse.
Die Therapie der ersten Wahl ist die vollständige, jedoch möglichst funktionserhaltende chirurgische Entfernung.
Eine wirksame Standardtherapie mit Medikamenten fortgeschrittener AFX/PDS ist nicht bekannt.
Der Einsatz von Checkpointinhibitoren könnte vielversprechend sein, ist jedoch nicht zugelassen.
- REFERENZEN
- Koelsche C, Stichel D, Griewank KG, Schrimpf D, Reuss DE, Bewerunge-Hudler M, et al. Genome-wide methylation profiling and copy number analysis in atypical fibroxanthomas and pleomorphic dermal sarcomas indicate a similar molecular phenotype. Clin Sarcoma Res. 2019;9:2.
- Helwig EB, May D. Atypical fibroxanthoma of the skin with metastasis. Cancer. 1986;57(2):368-76.
- Mentzel T, Requena L, Brenn T. Atypical Fibroxanthoma Revisited. Surg Pathol Clin. 2017;10(2):319-35.
- Dei Tos AP, Maestro R, Doglioni C, Gasparotto D, Boiocchi M, Laurino L, et al. Ultraviolet-induced p53 mutations in atypical fibroxanthoma. Am J Pathol. 1994;145(1):11-7.
- Persa OD, Loquai C, Wobser M, Baltaci M, Dengler S, Kreuter A, et al. Extended surgical safety margins and ulceration are associated with an improved prognosis in pleomorphic dermal sarcomas. J Eur Acad Dermatol Venereol. 2019.
- Bitel A, Schonlebe J, Kronert C, Wollina U. Atypical fibroxanthoma: An analysis of 105 tumors. Dermatol Ther. 2020:e13962.
- Miller K, Goodlad JR, Brenn T. Pleomorphic dermal sarcoma: adverse histologic features predict aggressive behavior and allow distinction from atypical fibroxanthoma. Am J Surg Pathol. 2012;36(9):1317-26.
- Tolkachjov SN, Kelley BF, Alahdab F, Erwin PJ, Brewer JD. Atypical fibroxanthoma: Systematic review and meta-analysis of treatment with Mohs micrographic surgery or excision. J Am Acad Dermatol. 2018;79(5):929-34 e6.
- Tardio JC, Pinedo F, Aramburu JA, Suarez-Massa D, Pampin A, Requena L, et al. Pleomorphic dermal sarcoma: a more aggressive neoplasm than previously estimated. J Cutan Pathol. 2016;43(2):101-12.
- Klein S, Persa OD, Mauch C, Noh KW, Pappesch R, Wagener-Ryczek S, et al. First report on two cases of pleomorphic dermal sarcoma successfully treated with immune checkpoint inhibitors. Oncoimmunology. 2019;8(12):e1665977.
- Klein S, Mauch C, Wagener-Ryczek S, Schoemmel M, Buettner R, Quaas A, et al. Immune-phenotyping of pleomorphic dermal sarcomas suggests this entity as a potential candidate for immunotherapy. Cancer Immunol Immunother. 2019.
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Nachsorge bei Sarkomen und seltenen Tumoren der Haut
Zuletzt aktualisiert: 14.01.2026 | Autor(in): Doris Helbig, Mirjana Ziemer
Die Nachsorge von Patienten mit AFX und PDS mit einer frühzeitigen Entdeckung von Rückfällen ist wichtig. Bei Patienten mit PDS ist außerdem die frühzeitige Erfassung von Lymphknoten- oder Fernmetastasen von Bedeutung.
Bei AFX werden halbjährliche klinische Untersuchungen einschließlich der Abtastung der Lymphknoten der Region, innerhalb der ersten beiden Jahre empfohlen. Anschließend jährlich für mindestens fünf Jahre (Tabelle 1).
Bei PDS werden in Abständen von 3 Monaten klinische Untersuchungen einschließlich der Abtastung der Lymphknoten der Region innerhalb der ersten beiden Jahre empfohlen. Im Anschluss werden halbjährliche Abstände für mindestens fünf Jahre empfohlen.
Bei PDS sollte in 6-monatlichen Abständen eine Ultraschalluntersuchung der ursprünglichen Tumorregion sowie der lokalen Lymphknoten erfolgen. Weiterführende Untersuchungen wie Computertomografie (CT) oder Magnetresonanztomografie (MRT) sind speziellen Situationen und Fragestellungen (so z.B. bei auffälligem Befund im Ultraschall) vorbehalten.
Nachsorgeschema für das atypische Fibroxanthom (AFX) und das pleomorphe dermale Sarkom (PDS)
| Jahr 1 & 2 | Jahr 3 – 8 (5 Jahre) | |
|---|---|---|
| AFX | Alle 6 Monate | Jährlich |
| PDS | Alle 3 Monate | Alle 6 Monate |
AFX und PDS treten am häufigsten am behaarten Kopf und im Gesicht auf.
Der Altersgipfel bei Erstdiagnose liegt im 7. bis 8. Lebensjahrzehnt, wobei überwiegend Männer betroffen sind.
Bei AFX kann nach vollständiger chirurgischer Entfernung von einer Heilung ausgegangen werden. Rückfälle treten zumeist in den ersten 2 Jahren auf und sind häufiger bei PDS.
- REFERENZEN
- Koelsche C, Stichel D, Griewank KG, Schrimpf D, Reuss DE, Bewerunge-Hudler M, et al. Genome-wide methylation profiling and copy number analysis in atypical fibroxanthomas and pleomorphic dermal sarcomas indicate a similar molecular phenotype. Clin Sarcoma Res. 2019;9:2.
- Helwig EB, May D. Atypical fibroxanthoma of the skin with metastasis. Cancer. 1986;57(2):368-76.
- Mentzel T, Requena L, Brenn T. Atypical Fibroxanthoma Revisited. Surg Pathol Clin. 2017;10(2):319-35.
- Dei Tos AP, Maestro R, Doglioni C, Gasparotto D, Boiocchi M, Laurino L, et al. Ultraviolet-induced p53 mutations in atypical fibroxanthoma. Am J Pathol. 1994;145(1):11-7.
- Persa OD, Loquai C, Wobser M, Baltaci M, Dengler S, Kreuter A, et al. Extended surgical safety margins and ulceration are associated with an improved prognosis in pleomorphic dermal sarcomas. J Eur Acad Dermatol Venereol. 2019.
- Bitel A, Schonlebe J, Kronert C, Wollina U. Atypical fibroxanthoma: An analysis of 105 tumors. Dermatol Ther. 2020:e13962.
- Miller K, Goodlad JR, Brenn T. Pleomorphic dermal sarcoma: adverse histologic features predict aggressive behavior and allow distinction from atypical fibroxanthoma. Am J Surg Pathol. 2012;36(9):1317-26.
- Tolkachjov SN, Kelley BF, Alahdab F, Erwin PJ, Brewer JD. Atypical fibroxanthoma: Systematic review and meta-analysis of treatment with Mohs micrographic surgery or excision. J Am Acad Dermatol. 2018;79(5):929-34 e6.
- Tardio JC, Pinedo F, Aramburu JA, Suarez-Massa D, Pampin A, Requena L, et al. Pleomorphic dermal sarcoma: a more aggressive neoplasm than previously estimated. J Cutan Pathol. 2016;43(2):101-12.
- Klein S, Persa OD, Mauch C, Noh KW, Pappesch R, Wagener-Ryczek S, et al. First report on two cases of pleomorphic dermal sarcoma successfully treated with immune checkpoint inhibitors. Oncoimmunology. 2019;8(12):e1665977.
- Klein S, Mauch C, Wagener-Ryczek S, Schoemmel M, Buettner R, Quaas A, et al. Immune-phenotyping of pleomorphic dermal sarcomas suggests this entity as a potential candidate for immunotherapy. Cancer Immunol Immunother. 2019.
INTERESSENSKONFLIKTE
Der Autor/die Autorin hat keine Interessenskonflikte angegeben.
Link copied to clipboard!